TiGenix, compañía europea líder en terapia celular, ha anunciado hoy resultados positivos de seguridad a seis meses para su estudio en Fase IIa de Cx611, su fármaco para artritis reumatoide (AR). Cx611 es un medicamento para el tratamiento de la artritis reumatoide compuesto de una suspensión de células madre adultas expandidas derivadas del tejido adiposo (grasa) humano que se administra mediante inyección intravenosa.
Lovaina (Bélgica), Madrid (España) – 22 de abril de 2013 - TiGenix NV (Euronext Brussels: TIG), compañía europea líder en terapia celular, ha anunciado hoy resultados positivos de seguridad a seis meses para su estudio en Fase IIa de Cx611 en artritis reumatoide (AR) así como una primera indicación de actividad terapéutica en base a variables estándar y marcadores biológicos de inflamación durante al menos tres meses después de la dosificación.
El estudio clínico en fase IIa de Cx611, multicéntrico, randomizado, doble ciego y controlado con placebo, reclutó 53 pacientes con AR activa refractaria (quince años desde el diagnóstico) que no habían respondido al menos a dos productos biológicos (mediana de tratamientos previos con 3 o más fármacos antirreumáticos modificadores de la enfermedad y 3 o más biológicos). El diseño del estudio estaba basado en un protocolo de escalado de dosis con tres cohortes. Tanto para los regímenes de dosis baja y media, 20 pacientes recibieron tratamiento activo y 3 pacientes recibieron placebo; para el régimen de dosis alta, seis pacientes recibieron tratamiento activo y 1 recibió placebo. Los pacientes fueron dosificados en los días 1, 8, y 15 y se realizó un seguimiento mensual durante un período de seis meses. El seguimiento consistió en una serie de análisis mensuales detallados de todos los parámetros predefinidos. El objetivo fue evaluar la seguridad, tolerabilidad y dosis óptima durante los seis meses completos del estudio, así como explorar la actividad terapéutica.
Sólo un paciente presentó efectos adversos graves que condujeron a la interrupción del tratamiento. El resto de los efectos secundarios fueron leves y transitorios. Es importante destacar que los primeros resultados no muestran signos de efectos secundarios hematológicos o trombosis.
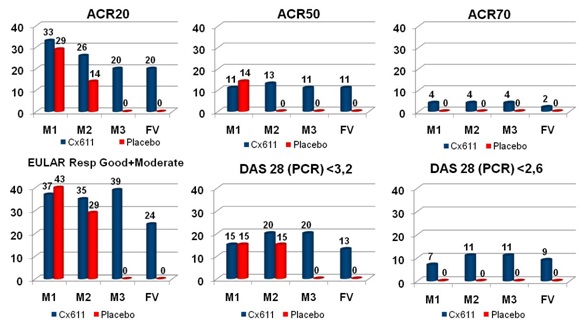
Los parámetros de actividad clínica medidos fueron ACR20(1), ACR50(1), ACR70(1), las tasas de respuesta EULAR(2), y el índice de actividad de la enfermedad DAS28(3). Para tener una primera visión del efecto terapéutico, estos parámetros fueron evaluados cada mes durante seis meses. Las siguientes tablas reflejan en porcentajes, los resultados acumulados de los tres brazos de tratamiento, al mes 1 (M1), mes 2 (M2), mes 3 (M3), y "última visita" (FV). Actualmente se está procediendo a un análisis pormenorizado de los datos.
“Este ensayo en Fase IIa es un estudio de referencia que nos ofrece una primera indicación del potencial de la terapia celular en la artritis reumatoide. La combinación de los datos positivos de seguridad con el nuevo mecanismo de acción es prometedora y merece seguir siendo investigada clínicamente” ha afirmado el Dr. José María Álvaro-Gracia, MD, PhD, Jefe de la Unidad de Terapias Biológicas en el Hospital Universitario de La Princesa, Madrid, e Investigador Principal del estudio.
“Es una satisfacción poder anunciar estos resultados positivos en nuestro ensayo clínico en Fase IIa de Cx611en artritis reumatoide” comenta Eduardo Bravo, Consejero Delegado de TiGenix. “Se trata de unos resultados prometedores ya que suponen un primer signo de actividad terapéutica en AR con terapia celular. Además, este logro ha ocurrido en el grupo de pacientes de AR probablemente más refractarios de los evaluados hasta la fecha en estudios clínicos. Por otro lado, estos datos proporcionan unos conocimientos clínicos y analíticos únicos que establecen las bases para una futura exploración de nuestra plataforma de eASC (células madre alogénicas adultas expandidas derivadas del tejido adiposo) en AR y en otras enfermedades autoinmunes e inflamatorias con importantes necesidades médicas no cubiertas”.
Sobre Cx611
Cx611 es un medicamento para el tratamiento de la artritis reumatoide compuesto de una suspensión de células madre adultas expandidas derivadas del tejido adiposo (grasa) humano –expanded Adipose derived Stem Cells, ‘eASCs’-, que se administra mediante inyección intravenosa.
Acerca del tratamiento de la artritis reumatoide (AR) con biológicos
Los biológicos de primera línea han mejorado significativamente las opciones terapéuticas en AR. Sin embargo, en más del 50% de los pacientes diagnosticados y tratados con AR, se hace necesario prescribir otros biológicos debido a la escasa respuesta o a la aparición de efectos secundarios. Se estima que entre un 5-10% de los pacientes con AR, en algún momento son refractarios a la mayoría de los biológicos disponibles. Sólo en EEUU, Europa y Japón, supone una población de 150.000-300.000 pacientes lo que implica una necesidad urgente de tratamientos seguros y eficaces.
Leyenda
(1) ACR 20 significa una mejora del 20% en el recuento de articulaciones dolorosas o inflamadas, así como una mejora del 20% en al menos tres de los siguientes cinco criterios: la evaluación del paciente, evaluación del médico, velocidad de sedimentación globular, grado de dolor y cuestionario funcional. Las categorías ACR50 y ACR70 se adhieren a los mismos criterios, pero para una mejora del 50% y del 70%, respectivamente. (2) EULAR, Asociación Europea Contra el Reumatismo (3) DAS28, índice de valoración del grado de la enfermedad que incluye recuento articular
Sobre TiGenix TiGenix NV (NYSE Euronext Brussels: TIG) es una compañía europea líder en terapia celular con un producto comercializado para la reparación del cartílago, ChondroCelect®, así como una sólida plataforma con programas de células madre adultas en fase clínica para el tratamiento de enfermedades autoinmunes e inflamatorias. TiGenix tiene sus oficinas en Lovaina (Bélgica), Madrid (España) y Sittard-Geleen (Holanda). Para más información: www.tigenix.com.
Información sobre previsiones futuras Este documento podría contener información sobre perspectivas de futuro y estimaciones en relación con los resultados futuros anticipados de TiGenix y el mercado en el que opera. Algunas de estas afirmaciones, previsiones y estimaciones puede reconocerse con el uso de palabras tales como, sin limitación, “cree”, “anticipa”, “espera”, “pretende”, “planea”, “intenta”, “estima”, “puede”, “podría” y “continúa” y expresiones similares. Éstas incluyen todos los asuntos que no son hechos históricos. Tales afirmaciones, previsiones y estimaciones están basadas en varios supuestos y valoraciones de riesgos conocidos y no conocidos, incertidumbres y otros factores, que fueron considerados razonables cuando se hicieron pero que pueden o no ser correctos. Los hechos exactos son difíciles de predecir y pueden depender de factores ajenos al control de la Compañía. Por tanto, los resultados exactos, la situación financiera, los resultados o los logros de TiGenix, o los resultados del sector, podrían ser materialmente diferentes de cualquier resultado o logros futuros expresados o implícitos en esas afirmaciones, previsiones y estimaciones. Dadas estas incertidumbres, no puede hacerse ninguna representación respecto a la exactitud o imparcialidad de esas afirmaciones de futuro, previsiones y estimaciones. Además, las afirmaciones de futuro, previsiones y estimaciones sólo hablan de la fecha de publicación de este documento. TiGenix renuncia a cualquier obligación de actualizar ninguna afirmación de futuro, previsión o estimación para reflejar cambio alguno en las expectativas de la Compañía en relación a eso, o cualquier cambio en los acontecimientos, condiciones o circunstancias en las que estén basadas dichas afirmaciones previsiones o estimaciones, excepto en la medida exigida por la ley belga.